【製造販売後調査とは】3つの種類、市販直後調査との違い、流れなどを徹底解説 #027

2022.12.23
2025.03.27
この記事では「製造販売後調査」について解説します。
「製造販売後調査」という言葉はあまり聞き慣れず、具体的な意味や手順などを理解することは難しいかもしれませんが、この記事を読むことでその概要を掴めます。
この記事では、
- 製造販売後調査の概要、目的、種類、流れ
- 市販直後調査との違い
などについて徹底的に解説していきます。
目次
製造販売後調査とは
製造販売後調査 (Post-Marketing SurveillanceまたはPMS) は、医薬品や医療機器の販売が承認されて市場で使用された後に、及び適用拡大の際にそれらの安全性を監視する手法の一つです。
厚生労働省の指示のもと製造販売業者(製薬会社や医療機器メーカー)が医療機関(病院や診療所)を対象に調査し、その内容を厚生労働省に報告します。
製造販売後調査の目的
製造販売後調査の目的は、有効性と安全性の確認で、販売前の治験や臨床試験などで得られなかった有用性の指標や長期のデータを収集します。なぜなら、販売前に得られる情報には限界があるからです。
そして、製造販売後調査には以下のようなメリットがあります。
- 市場で使用された多数のデータを活用することで、医薬品または医療機器の安全性を改善できる
- 臨床試験段階よりもはるかに多くの情報が得られる
製造販売後調査の実施
承認を受けた製造販売業者は、原則として8年間、該当医薬品の使用の成績について調査して、再度有効性と安全性を確認するという再審査制度が義務付けられています。ただし製造販売後調査は「使用の成績について調査」の一部となり他の調査方法もあります。実施が必要と判断された場合に製造販売後調査を実施します。
製造販売後調査の主な3つの種類
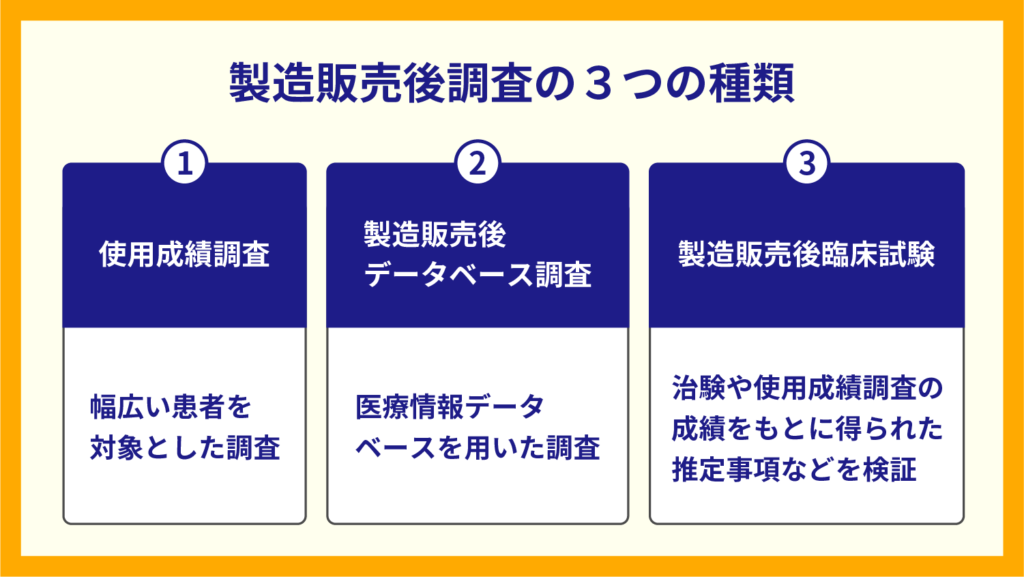
製造販売後調査では主に以下の3つが実施されています。
- 使用成績調査
- 製造販売後データベース調査
- 製造販売後臨床試験
それぞれ詳しく解説していきます。
①使用成績調査
使用成績調査とは、新薬の市販開始後に、幅広い患者さんに対してその品質や有効性・安全性を調べることです。
使用成績調査の主な目的は、未知の副作用の発見や研究、安全性・有効性に影響を与える要因の確認などです。
さらに、使用成績調査のうち、以下のような患者条件を定めて調査することを特定使用成績調査と言います。
- 小児
- 高齢者
- 妊産婦
- 肝腎機能障害を有する方
- 長期使用者
②製造販売後データベース調査

製造販売後データベース調査では、
- 病院情報システムデータ(電子カルテデータ、DPCデータなど)
- 診療報酬並びに調剤報酬明細書(健康保険組合レセプトデータなど)
- 疾患登録データ
といった医療情報データを用いて、医薬品の有用性・安全性の確認、副作用による疾患の発現状況の検出などを実施します。
例えば、調査する場合にはこのような項目に沿って調査します。
- どのような患者に処方されているか
- 有害事象があるか
- 類似薬と比較して副作用の発現頻度は増加しているか
- 禁忌患者への投与は減少しているか
③製造販売後臨床試験
製造販売後臨床試験とは、治験や使用成績調査検討の結果、得られた推定事項を検証するための臨床試験です。
製造販売後臨床試験が実施される理由は、実際の医療現場では医薬品や医療機器が治験の段階とは異なる状況下で使用されることもあり、治験では分からなかった製品の効果や副作用が発見される場合があるからです。
このように、医薬品や医療機器は市販開始後にも継続的に調査されます。その結果は厚生労働省に報告されて再び審査されます。
製造販売後調査の流れ
製造販売後調査は、おおよそ以下のような流れで実施されます。
- 実施計画の策定
- 安全性の定期報告
- 再審査・再評価
それぞれについて詳しく解説します。
①実施計画の策定
製造販売後調査を実施する前に、実施が必要かどうかを判断するため、以下のような実施計画を策定します。
- 安全性監視計画:主に副作用に関する情報を収集するための計画
- リスク最小化計画:特定のリスクを最小化するための計画
具体的には、製造販売後調査、添付文書や医薬品ガイド、市販直後調査による報告書の作成などが含まれます。
これらの実施計画を策定することで、目的が不明瞭な調査を漫然と実施することを防止し、調査目的や必要性を明確にすることができます。
②安全性の定期報告
続いて製造販売後調査が承認されたら、実際に調査して副作用や感染症の有無を報告します。
使用成績調査・製造販売後データベース調査・製造販売後臨床試験などを実施して、安全性について定期的に報告します。
③再審査・再評価
安全性の報告が終わると、製薬会社は製造販売開始後定められた再審査期間内に市場における品質・有効性・安全性を再確認・評価します。調査期間は4年〜10年です。
さらに、厚生労働省は再審査後に再評価として新薬の妥当性を見直すことができます。
製造販売後調査には管理責任者が必要
製造販売後調査には、業務の統括者となる「管理責任者」が必要となります。
前提として、管理責任者は販売に係る部門に属してはいけません。そして、次のような業務を担当します。
- 実施に関する企画、立案及び調整
- 業務手順書や計画書などに基づいて、調査が適正かつ円滑に実施されているかの確認
- 結果に関する文書報告
- 必要に応じて文書の改訂
製造販売後調査業務における情報収集や業務手順などに関する定期的な自己点検も義務付けられています。
製造販売後調査の保存期間
製造販売後調査には保存期間があり、実施した医療機関は、基本的に厚生労働大臣による再審査又は再評価が終了する日まで調査に関する情報や記録を保存しなければなりません。
製造販売後臨床試験に移行しない治験実施医療機関の場合、製造販売の承認を受けた日、または治験の中止・終了後3年を経過した日のうちいずれか遅い日までが保存期間となります。
例えば、治験を実施している医療機関が追加の調査として製造販売後臨床試験を行わない場合、治験の終了から3年が保存期間となります。
製造販売後調査と市販直後調査の違い
製造販売後調査と近しい概念として、市販直後調査があります。
この章では、製造販売後調査と市販直後調査の違いについて解説します。
そもそも市販直後調査とは
市販直後調査とは、販売開始から6ヶ月間に行われる、新医薬品の安全性と有効性を確認する調査で、以下のような目的があります。
- 新薬の適正使用の促進:医療機関に対し確実な情報提供、注意喚起をして、新薬の適正使用に関する理解を促す
- 副作用の被害の最小化:重篤な副作用または感染症などの情報を迅速に収集し、必要な安全対策を実施することにより、副作用などの被害を最小化する
開発段階から市販後に至るまで新薬のリスクを適切に管理する方策「医薬品リスク管理計画(RMP:Risk Management Plan)」の一環で、必要と認められた際に行われます。
市販直後調査の対象としては、主に病院や診療所となっています。原則的ではありませんが、薬局も対象となる場合もあります。
市販直後調査により、早い段階で重い副作用を引き起こす可能性があることが分かるようになりました。そのため、今では薬全体の有効性・安全性を保つために不可欠な調査となっています。
製造販売後調査と市販直後調査の具体的な違い

製造販売後調査と市販直後調査の細かな違いについて解説します。
製造販売後調査はGPSP(Good Post-marketing Study Practice)という規定に基づいて行われます。販売前に得ることができなかった情報を収集して、再審査や再評価を行います。
一方で市販直後調査は、製品の安全確保措置を図るためにGVP(Good Vigilance Practice)という規定に基づいて実施されます。いわば、新薬の副作用報告に焦点を当てた調査と言えます。
調査期間については、製造販売後調査が4-10年間なのに対して市販直後調査は6ヶ月間です。
市販直後調査の頻度は、初めの2ヶ月間は2週間以内に1回、その後は1ヶ月以内に1回程度です。
製造販売後調査の課題
製造販売後調査の課題は、医療現場での負担が大きい点です。
具体的には、医薬品の使用成績調査の契約、症例登録、副作用の事例などの有害事象の収集などが挙げられます。
また、症状が原疾患(おおもとの病気)によるものなのか、薬剤によるものなのか、区別がつきづらい場面もあります。
医療情報データベース調査の際はお気軽にご相談下さい
従来の製造販売後調査に加えて、GSPS省令の改正以降は処方実態や治療実態を調査する「医療情報データベース調査」などの新たな手法が徐々に浸透しています。
医療情報データベース調査により、製造販売業者は安全性の確認だけではなく今後の製品戦略や市場実態調査に役立てることができます。
当社メディカル・データ・ビジョンは、病院データの登録患者及び病院総数が4,158万人(2022年10月末現在)・473施設(同)と日本最大規模の診療データベースを保有しており、製造販売後データベース調査に活用していただけます。
分析対象となる患者のデータを集積・解析し、集計レポートとしてご提供することも可能です。
製薬会社・医療機器メーカーなどの多くの医療関連会社様にご活用いただいており、数多くの事例がございます。
医療情報データベース調査の際は、当社までお気軽にご相談ください。





